iQ专栏:从《我不是药神》电影谈起——你是否了解药物研发的漫漫征途
原研药到底贵在何处呢?其天价到底包括了哪些因素?本文着眼于药物研发成本和药物研发流程,揭秘天价原研药的背后秘辛。

即使您没走进电影院观影,可能已通过朋友圈和公众号里的排山倒海般的文章了解到了现今最热的电影《我不是药神》。这部现实主义题材的电影只是反映站在天平两端的病人群体和医药公司现状的一个缩影。
除了该部电影,全球范围内还有以下几部与医药相关的电影,小编推荐给大家。
1
《达拉斯买家俱乐部》(Dallas Buyers Club),根据美国的真人真事改编,由著名演员马修 • 麦康纳(Matthew McConaughey)和杰瑞德 • 莱托(Jared Leto)主演,两位也凭此片分别获得了奥斯卡最佳男主角和最佳男配角。主要讲述了男主角被确诊为艾滋病晚期,为了能够活下去,研究各类未受美国FDA批准的抗艾滋病药物和替代疗法,甚至非法走私并为病友提供全世界各地的抗艾滋病药物的故事。
2
《良医妙药》(Extraordinary Measures), 由著名演员布兰登 • 弗雷泽(Brendan Fraser)和哈里森 • 福特(Harrison Ford)主演。影片讲述了男主角为了挽救自己两个患有罕见的遗传类疾病-庞倍氏症(Pompe disease)的孩子,而成立医药公司自行研制新药并最终获得FDA批准的故事。
3
《生存证明》(Living Proof),影片讲述了著名医生丹尼斯 • 斯拉蒙(Dennis Joseph Slamon)历经千辛万苦研究出了治疗乳腺癌的新药-赫赛汀(Herceptin)的故事。赫赛汀为靶向治疗药物,可使乳腺癌患者的整体存活率提高34%,并减少50%再复发机率。
这些电影折射出的真实社会问题不容忽视。原研药之贵令癌症病人负担不起,而科学家在开发原研药的过程中最大的困难却恰恰是面临资金短缺。小编现从药物研发成本和药物研发流程这两方面揭秘天价原研药的背后秘辛。
药物研发成本
—— 研发“烧钱”的根本原因
医药圈流传着一种说法,“靶向药之所以昂贵到要卖几万元,那是因为你能买到的已经是第二颗药了,第一颗药的价格是数十亿美金。”言下之意,天价药不能归罪于药企贪婪,而是研发成本巨大。
巨大的研发成本到底是由哪些方面构成的呢?
资金投入高:由美国塔夫茨大学药物开发研究中心(Tufts Center for the Study of Drug Development)发布的一份报告显示,开发一个新药的平均成本大约为25.6亿美元,而这还没算上每个药物平均3.12亿美元的售后开支。
历经时间长:一种新药从发现到通过批准,平均需历时12年左右。包括:实验室发现(约4年)-临床前研究(约1.5年)-临床研究(约5年)-监管批准(约1.5年)。
大量研发人员:平均每种新药的研发团队可达到超过100人的规模,涵盖科学家、临床医学专家、医疗事务顾问、药品产品开发人员等。
新药上市审批风险高、难度大:美国的新药审批是世界上最严格和规范的,可谓“宽进严出”。在完成所有三个阶段的临床试验并分析所有资料及数据后,如证明该药物的安全性和有效性,则可以向美国食品与药物管理局(FDA)提交新药申请。新药申请需要提供所有收集到的科学资料。通常一份新药申请材料可多达10万页甚至更多。从2008年到2017年的十年间,平均每年仅有31种新药获批上市。
以诺华公司(Novartis AG)(电影中神药“格列宁”的原型“格列卫(Gleevec)”是由诺华公司成功开发上市)为例,根据诺华2017年财报显示,2017年其在研发方面投入了90亿美元,占净收入的18.3%。创新药部门研发和实验室开发投入达到27亿美元。仅2017年,诺华在全球有23,000名科学家、临床医师和商业精英致力于研发前线,超过200项研究复合物进入到临床阶段。
从1997年到2011年间,诺华公司一共在研发新药上投入了836亿美元的成本,其中只有21种药成功获批上市,平均算起来每个新药背后花费了40亿美元。
药物研发流程概述
那我们再来看一下药物研发漫漫征途的一步步关卡。药物研发的流程在全球范围内大致相同,一共分为以下五个阶段。
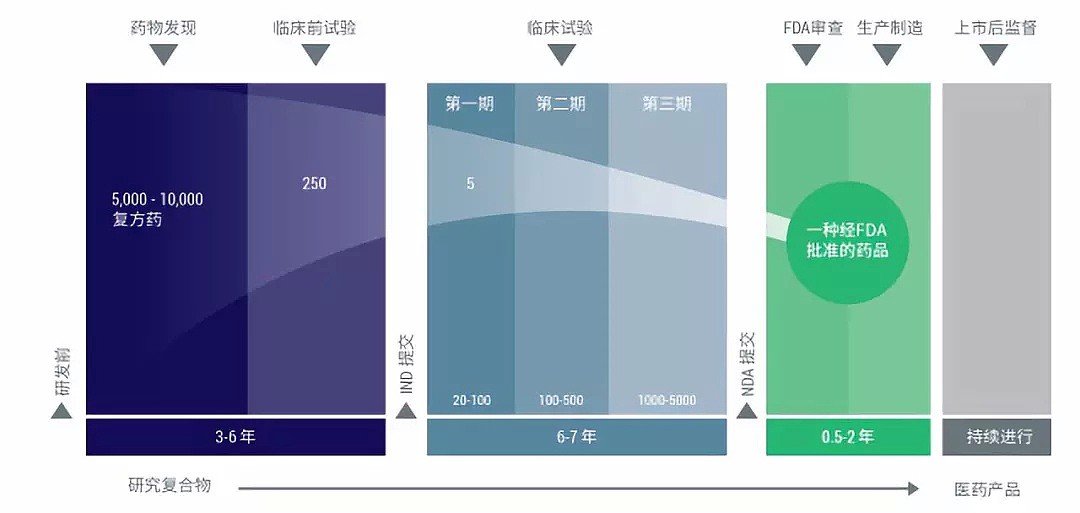
(图片来源:iQ集团官方网站)
第一阶段:药物发现
在此阶段,研究人员一般基于以下四点着手制定新药研制计划:
1)根据对某种疾病的病理过程的新认知寻找到新的角度抑制或扭转疾病对人体的影响
2)在对大量化合物的研究测试中发现某物质对治疗某种疾病的潜在可能
3)针对现有治疗药物的不足之处进行改良
4)通过新技术实现靶向治疗和基因治疗
一旦某种新型化合物被锁定,研究人员将从其药性、作用机制、潜在副作用、与其他药物的交互作用(是否存在相互排斥等)、最佳使用剂量、最佳推给途径、潜在群体差异等方面进行大量实验研究,并对收集到的数据进行深入分析。一般每20-40种化合物中有1种可进入下一轮。
第二阶段:临床前试验
此阶段的主要任务是通过体外试验和活体(动物)实验检测药物毒性。在此阶段,研究人员需谨遵《药物非临床研究质量管理规范》(GLP),对药物的药理、毒理、稳定性、合成工艺、制备工艺等进行方方面面的检测。尽管药物临床前研究的规模通常并不十分庞大,但是研究人员需在此阶段给出明确的剂量使用范围和药物毒性数据,以决定新药能否进入下一阶段的临床研究。在该阶段仅有1/50的化合物可进入下一轮。
第三阶段:药物临床研究
虽然药物临床前研究保障了药物使用上的安全性,但并不能保证该药在应用于人体时能产生预期的疗效,该检测任务将在药物临床研究阶段逐步完成。药物临床研究一般分四期进行:
1)I期:主要检测药物的安全性和人体对药物的耐受性。通常由20-100人的健康志愿者或患有相对应病症的患者组成受试群体。I期研究一般历时数个月,约有70%的药物可以顺利进入下一期的研究。
2)II 期:主要检测药物的临床疗效和副作用。通常由上百位患有相对应病症的患者组成受试群体。II期研究历时少则数月,多则2年,仅有约33%的药物能够进入下一期的研究。
3)III 期:进一步监测药物的临床疗效以及潜在的不良反应。通常由300-3000名患有相对应病症的患者组成受试群体。III期研究历时1至4年,仅有约25%-30%的药物能进入最后一期的研究。
4)IV 期:在药物上市前对该药物的安全性和药效进行再一次的检测。通常由数千名健康志愿者或患有相对应病症的患者组成受试群体。尽管经历了前三期临床研究的严格筛选,仍有约8.2%的新药将在第IV期因各种原因被淘汰。
通常情况下,在历时3-7年之久的临床研究阶段之后,只有约20%的新药能够被允许进入到下一阶段的审核。
第四阶段:药物审查
监管机构(在美国是FDA, 在澳洲是TGA, 在中国是CFDA)将对通过临床研究的药物的申报材料进行层层审查,对研制情况及条件进行现场考察,并对药物样品进行抽检。
第五阶段:药物上市后的长期安全性监测
尽管临床实验已对新药的药效和安全性进行了极为严格的审查和筛选,该阶段的研究仍有其局限性。例如,由于时间所限,药物的长期疗效及安全性数据很难在审批时全部获得。因此,药物上市后将经过数月至数年的持续监测,以对药物的疗效、安全性和最佳用量进行更缜密的判断,并对潜在副作用及不良反应及时作出处理。
因为医药研发时间长,成本高,医药公司需要在专利到期前收回成本,从而能有资金进行更多新药开发,进而形成一个“新药研发-药品上市-收回成本-进一步投入新药研发”的良性循环。在良性循环的作用下,最终受惠的还是普罗大众,尤其是现在还无药可医的病人,他们更期盼看到的是救命良药的上市。
文末彩蛋——
那什么是“仿制药”?
前文谈到的几部电影中大多提到了原研药和仿制药。本文综述的药物研发成本和研发流程都是针对“原研药”而言的。那什么是“仿制药”呢?
相对于“原研药”是指原创性的新药,“仿制药”则是指与相对应的原研药在剂量、安全性、效力、质量、作用及适应症上相同的一种仿制品。简单来讲,在原研药的专利药品保护期到期后,任何制药厂可合法生产对应仿制药。因仿制药的研制难度和审核的时间成本大幅下降,其市场价比原研药要低很多。而其与原研药具有相同的活性成分、剂型、给药途径和治疗作用,在质量与疗效上需与原研药一致,在临床上与原研药可相互替代。
因此,“仿制药”并非“冒牌药”、“山寨药”或“假药”。合法的“仿制药”,其研制与生产也需通过严密流程和严格审核来完成。








 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


